Chimie:(8pts)

On donne Al=27g.mol-1 et S=32g.mol-1.
Le sulfure d'aluminium Al2S3 est obtenu à la suite de la réaction
entre l'aluminium Al
et le soufre S.
- Ecrire l'équation équilibrée de cette réaction.
- Dans une première expérience, on utilise 8,1g d'aluminium.
Quelle masse de sulfure d'aluminium obtient-on?
- Dans une deuxième expérience, on fait réagir 16,2g d'aluminium et 30g de soufre.
Calculer la masse de soufre restant en fin de réaction.
- Dans une troisième expérience, on utilise 0,5mol d'aluminium et 0,6mol de soufre.
a-Y-a-t-il un réactif en excès? Si oui préciser lequel en justifiant la réponse.
b-Déterminer le nombre de moles et la masse de sulfure d'aluminium obtenu.
Physique:
I-Questions de compréhension:(2pts)
- Enoncer la loi de maille relative à la tension électrique.
- Enoncer la loi de nœuds relative à l'intensité du courant.
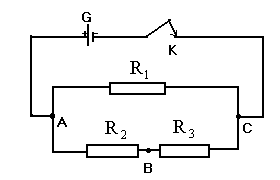
II-Exercice:(10pts)
On considère le montage schématisé ci-dessous avec:
*G un générateur de courant continu et K un interrupteur.
*R1 ; R2 ; R3 trois résistors.
 |