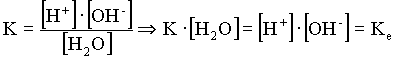Loi
d'action de masse et évolution |
||||||||||||
L'étude de la réaction d'estérification
permettra de montrer que cette réaction est limitée par une réaction inverse
(l'hydrolyse). Cette étude expérimentale permettra d'établir l'expression de la loi
d'action de masse: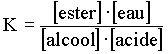 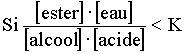 La réaction évoluera dans le sens de l'estérification. 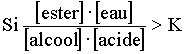 La réaction évoluera dans le sens de l'hydrolyse. On admettra que,pour toute transformation à une température donnée aboutissant à un équilibre du type: la loi d'action de masse s'écrit: 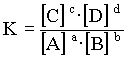 L'élève sera capable de (d'):
|