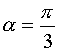Chimie: Les deux exercices 1 et 2 sont indépendants. Exercice 1: La dissociation du pentachlorure de phosphore aboutit à un équilibre chimique schématisé par l'équation : La dissociation (sens direct) est exothermique. 1)Prévoir, en le justifiant ; le sens du déplacement de l'équilibre précédent si : a-On comprime le mélange gazeux. b-On augmente sa température. c-On élimine le trichlorure de phosphore. 2)Une mole de pentachlorure de phosphore est placée dans un récipient de volume V=2L à la température T. L'équilibre s'établit lorsque 36% du PCl5 initial se sont dissociés. a- Déterminer la composition molaire du mélange gazeux à l'équilibre. b- Calculer la constante d'équilibre Kc relative aux concentrations molaires à la température T. 3)La température est maintenue constante, on diminue brusquement le volume jusqu'au V'=1,5L. a- La composition molaire précédente subira-t-elle un changement ? Si oui dans quel sens l'équilibre va-t-il se déplacer ? Justifier. b- Déterminer la nouvelle composition du mélange à l'équilibre. c- Chercher la nouvelle valeur du taux de dissociation de PCl5. Montrer que ce résultat est compatible avec les prévisions qualitatives que l'on pouvait faire. Exercice 2: On effectue l'oxydation des ions iodure I- par les ions peroxodisulfate S2O8= en faisant réagir de l'iodure de potassium sur du peroxodisulfate de potassium. Le mélange initialement incolore devient jaunâtre par suite de l'apparition progressive du diiode I2. 1)Ecrire l'équation bilan de la réaction qui se produit. 2)Le mélange étant maintenu à 20°C. Les molarités initiales des ions réagissant sont: [I-]o=4.10-2mol.L-1 et [S2O8=]o=2.10-2mol.L-1.Des prélèvements des volumes négligeables par rapport au volume total du mélange, permettent à intervalles de temps constants, de doser le diiode présent. On obtient les valeurs suivantes :
a- Tracer convenablement la courbe [I2]=f(t). Déterminer [I-]
à t=35min.
|